Leitungsband und Valenzband
Leitungsband & Valenzband
Faszinierende Physik im Inneren der Solarzelle
Zum Vergrößern bitte Grafik anklicken
Wärme hebt Silizium-Elektronen ins Leitungsband -
Darstellung © 2012 - 2018 ff Photovoltaiksolarstrom.com
nach Mertens (2011)
Leitungsband und Valenzband sind zwei zentrale Begriffe des Energiebändermodells.
Das Bändermodell dient in der Physik vor allem zur Beschreibung der elektrischen Leitfähigkeit von Halbleitern, wie sie in der Photovoltaik Verwendung finden.
Vom Atom- zum Bändermodell
Grundlage des Energiebändermodells ist das Atommodell des dänischen Physikers Niels Bohr, in dem Atome aus einem Kern bestehen, der ungeladene Neutronen und positiv geladene Protonen enthält; und aus einer Hülle mit negativ geladenen Elektronen, die um den Kern kreisen.
Nach Bohr dürfen sich die Elektronen dabei nur auf bestimmten, voneinander getrennten Bahnen - den sogenannten Schalen - bewegen, wobei die einzelnen Schalen lediglich eine begrenzte Zahl an Elektronen aufnehmen können (2, 8, 18, 32, etc.).
Die Energie der auf ihrer Bahn kreisenden Elektronen ist durch den Abstand vom Atomkern definiert und nimmt mit zunehmendem Bahnradius zu.
Um ein Elektron auf die nächsthöhere Schale anheben und den Energieabstand zwischen den Schalen überwinden zu können, muss von außen Energie eingebracht werden.
Zum Vergrößern Grafik anklicken
Die Entstehung von Energiebändern in einem Halbleiter
- schematische Darstellung nach Mertens (2011)
© 2012 nau
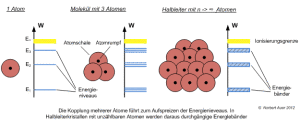
Um diesen Energieschritt nicht nur beim einzelnen Atom, sondern bei Molekülen oder Festkörper zu verstehen, wurde das Bohr'sche Atommodell zum Bändermodell weiterentwickelt (vgl. Grafik links).
Elektronen können im Atommodell verschiedene "Energiezustände" einnehmen - im Material eines Festkörpers hingegen bewegen sie sich auf "Energiebändern".
Nähern sich die Einzelatome im Festkörper aneinander an, sind ihre einzelnen Energieniveaus nicht mehr voneinander zu unterscheiden. Statt von exakt definierten Zuständen wie beim Einzelatom sind sie zum Energieband verschmolzen.
Für das elektrische Verhalten eines Festkörpers sind insbesondere zwei dieser Energiebänder relevant:
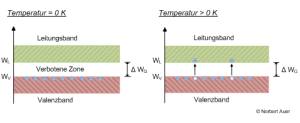
- Das Valenzband (WV), welches das höchste noch von Elektronen besetzte Energieband bezeichnet.
- Das Leitungsband (WL), das als das nächsthöhere Energieband definiert ist, das bei 0 Kelvin - dem absoluten Nullpunkt von -273,15 °C - keine Elektronen enthält.
Elektrisch leitfähig ist ein Material, wenn wenigstens eines dieser Bänder teilweise mit Ladungsträgern (Elektronen oder "Löchern") besetzt ist.
Bei einem vollständig belegten Valenzband findet - wie beim Stau auf der Autobahn - ein Transport nicht statt.
Bei einem vollständige leeren Leitungsband gilt dasselbe umgekehrt - auf einer vollständig leeren Autobahn wird nichts transportiert: Ohne Ladung kein Ladungstransport.
Wenn - wie beim Halbleiter - zwischen den Energiebändern eine Lücke klafft, spricht man im Bändermodell von einer Bandlücke (Δ WG).
Um Halbleiter wie Silizium elektrisch leitfähig zu machen, müssen Elektronen nun vom Valenz- über die Bandlücke zum Leitungsband angehoben werden.
Die dazu notwendige Energie wird dem einzelnen Elektron entweder über Wärme zugeführt oder schlägt - wie in der Solarzelle - mit den Quanten des Sonnenlichts ein.
Ist aber die Energie des einstrahlenden Quants zu gering, um die Bandlücke zu überspringen - oder die Bandlücke zu groß (wie z.B. regelmäßig bei Keramik-Isolatoren) -, so verbleibt das Elektron auf dem Valenzband.
Faszinierende Physik im Inneren der Solarzelle

Zum Vergrößern bitte Grafik anklicken
Wärme hebt Silizium-Elektronen ins Leitungsband -
Darstellung © 2012 - 2018 ff Photovoltaiksolarstrom.com
nach Mertens (2011)
Leitungsband und Valenzband sind zwei zentrale Begriffe des Energiebändermodells.
Das Bändermodell dient in der Physik vor allem zur Beschreibung der elektrischen Leitfähigkeit von Halbleitern, wie sie in der Photovoltaik Verwendung finden.
Vom Atom- zum Bändermodell
Grundlage des Energiebändermodells ist das Atommodell des dänischen Physikers Niels Bohr, in dem Atome aus einem Kern bestehen, der ungeladene Neutronen und positiv geladene Protonen enthält; und aus einer Hülle mit negativ geladenen Elektronen, die um den Kern kreisen.
Nach Bohr dürfen sich die Elektronen dabei nur auf bestimmten, voneinander getrennten Bahnen - den sogenannten Schalen - bewegen, wobei die einzelnen Schalen lediglich eine begrenzte Zahl an Elektronen aufnehmen können (2, 8, 18, 32, etc.).
Die Energie der auf ihrer Bahn kreisenden Elektronen ist durch den Abstand vom Atomkern definiert und nimmt mit zunehmendem Bahnradius zu.
Um ein Elektron auf die nächsthöhere Schale anheben und den Energieabstand zwischen den Schalen überwinden zu können, muss von außen Energie eingebracht werden.

Zum Vergrößern Grafik anklicken
Die Entstehung von Energiebändern in einem Halbleiter
- schematische Darstellung nach Mertens (2011)
© 2012 nau
Um diesen Energieschritt nicht nur beim einzelnen Atom, sondern bei Molekülen oder Festkörper zu verstehen, wurde das Bohr'sche Atommodell zum Bändermodell weiterentwickelt (vgl. Grafik links).
Elektronen können im Atommodell verschiedene "Energiezustände" einnehmen - im Material eines Festkörpers hingegen bewegen sie sich auf "Energiebändern".
Nähern sich die Einzelatome im Festkörper aneinander an, sind ihre einzelnen Energieniveaus nicht mehr voneinander zu unterscheiden. Statt von exakt definierten Zuständen wie beim Einzelatom sind sie zum Energieband verschmolzen.
Für das elektrische Verhalten eines Festkörpers sind insbesondere zwei dieser Energiebänder relevant:
- Das Valenzband (WV), welches das höchste noch von Elektronen besetzte Energieband bezeichnet.
- Das Leitungsband (WL), das als das nächsthöhere Energieband definiert ist, das bei 0 Kelvin - dem absoluten Nullpunkt von -273,15 °C - keine Elektronen enthält.
Elektrisch leitfähig ist ein Material, wenn wenigstens eines dieser Bänder teilweise mit Ladungsträgern (Elektronen oder "Löchern") besetzt ist.
Bei einem vollständig belegten Valenzband findet - wie beim Stau auf der Autobahn - ein Transport nicht statt.
Bei einem vollständige leeren Leitungsband gilt dasselbe umgekehrt - auf einer vollständig leeren Autobahn wird nichts transportiert: Ohne Ladung kein Ladungstransport.
Wenn - wie beim Halbleiter - zwischen den Energiebändern eine Lücke klafft, spricht man im Bändermodell von einer Bandlücke (Δ WG).
Um Halbleiter wie Silizium elektrisch leitfähig zu machen, müssen Elektronen nun vom Valenz- über die Bandlücke zum Leitungsband angehoben werden.
Die dazu notwendige Energie wird dem einzelnen Elektron entweder über Wärme zugeführt oder schlägt - wie in der Solarzelle - mit den Quanten des Sonnenlichts ein.
Ist aber die Energie des einstrahlenden Quants zu gering, um die Bandlücke zu überspringen - oder die Bandlücke zu groß (wie z.B. regelmäßig bei Keramik-Isolatoren) -, so verbleibt das Elektron auf dem Valenzband.
Faszinierende Physik im Inneren der Solarzelle

Zum Vergrößern bitte Grafik anklicken
Wärme hebt Silizium-Elektronen ins Leitungsband -
Darstellung © 2012 - 2018 ff Photovoltaiksolarstrom.com
nach Mertens (2011)
Leitungsband und Valenzband sind zwei zentrale Begriffe des Energiebändermodells.
Das Bändermodell dient in der Physik vor allem zur Beschreibung der elektrischen Leitfähigkeit von Halbleitern, wie sie in der Photovoltaik Verwendung finden.
Vom Atom- zum Bändermodell
Grundlage des Energiebändermodells ist das Atommodell des dänischen Physikers Niels Bohr, in dem Atome aus einem Kern bestehen, der ungeladene Neutronen und positiv geladene Protonen enthält; und aus einer Hülle mit negativ geladenen Elektronen, die um den Kern kreisen.
Nach Bohr dürfen sich die Elektronen dabei nur auf bestimmten, voneinander getrennten Bahnen - den sogenannten Schalen - bewegen, wobei die einzelnen Schalen lediglich eine begrenzte Zahl an Elektronen aufnehmen können (2, 8, 18, 32, etc.).
Die Energie der auf ihrer Bahn kreisenden Elektronen ist durch den Abstand vom Atomkern definiert und nimmt mit zunehmendem Bahnradius zu.
Um ein Elektron auf die nächsthöhere Schale anheben und den Energieabstand zwischen den Schalen überwinden zu können, muss von außen Energie eingebracht werden.

Zum Vergrößern Grafik anklicken
Die Entstehung von Energiebändern in einem Halbleiter
- schematische Darstellung nach Mertens (2011)
© 2012 nau
Um diesen Energieschritt nicht nur beim einzelnen Atom, sondern bei Molekülen oder Festkörper zu verstehen, wurde das Bohr'sche Atommodell zum Bändermodell weiterentwickelt (vgl. Grafik links).
Elektronen können im Atommodell verschiedene "Energiezustände" einnehmen - im Material eines Festkörpers hingegen bewegen sie sich auf "Energiebändern".
Nähern sich die Einzelatome im Festkörper aneinander an, sind ihre einzelnen Energieniveaus nicht mehr voneinander zu unterscheiden. Statt von exakt definierten Zuständen wie beim Einzelatom sind sie zum Energieband verschmolzen.
Für das elektrische Verhalten eines Festkörpers sind insbesondere zwei dieser Energiebänder relevant:
- Das Valenzband (WV), welches das höchste noch von Elektronen besetzte Energieband bezeichnet.
- Das Leitungsband (WL), das als das nächsthöhere Energieband definiert ist, das bei 0 Kelvin - dem absoluten Nullpunkt von -273,15 °C - keine Elektronen enthält.
Elektrisch leitfähig ist ein Material, wenn wenigstens eines dieser Bänder teilweise mit Ladungsträgern (Elektronen oder "Löchern") besetzt ist.
Bei einem vollständig belegten Valenzband findet - wie beim Stau auf der Autobahn - ein Transport nicht statt.
Bei einem vollständige leeren Leitungsband gilt dasselbe umgekehrt - auf einer vollständig leeren Autobahn wird nichts transportiert: Ohne Ladung kein Ladungstransport.
Wenn - wie beim Halbleiter - zwischen den Energiebändern eine Lücke klafft, spricht man im Bändermodell von einer Bandlücke (Δ WG).
Um Halbleiter wie Silizium elektrisch leitfähig zu machen, müssen Elektronen nun vom Valenz- über die Bandlücke zum Leitungsband angehoben werden.
Die dazu notwendige Energie wird dem einzelnen Elektron entweder über Wärme zugeführt oder schlägt - wie in der Solarzelle - mit den Quanten des Sonnenlichts ein.
Ist aber die Energie des einstrahlenden Quants zu gering, um die Bandlücke zu überspringen - oder die Bandlücke zu groß (wie z.B. regelmäßig bei Keramik-Isolatoren) -, so verbleibt das Elektron auf dem Valenzband.
Bandlücke und elektrische Leitfähigkeit
Die Größe der Bandlücke, also der Bandabstand zwischen Valenzband und Leitungsband bestimmt die Leitfähigkeit verschiedener Materialien.
Wie viel Energie (gemessen in Elektronen-Volt eV) ist notwendig, um die Bandlücke zu überwinden?
| Bandlücke Δ WG in Elektronenvolt [eV] | ||
|---|---|---|
| Leiter | Halbleiter | Isolatoren |
| ≤ 0 | > 0 - 3 (5)* | ≥ 3 (5)* |
* Diese Bandlückenwerte variieren in der Fachliteratur
Mit einem Bandabstand von 1,11 eV gehört das in kristallinen Solarzellen verwendete Silizium (Si) ebenso zu den Halbleitern wie bspw. das in der Dünnschichttechnologie eingesetzte Cadmiumtellurid (CdTe) mit einer Bandlücke von 1,44 eV.
Zum Vergleich:
In die Gruppe der Isolatoren fallen die Dimanten, die etwa einen Bandabstand von 7,3 eV aufweisen. In die Gruppe der Leiter fällt der Großteil aller Metalle.
Valenzband und Leitungsband in der Photovoltaik
Zum Vergrößern bitte Grafik anklicken
Photonen heben Elektronen ins Leitungsband -
schematische Darstellung nach Quaschnig (2011)
© 2012 Photovoltaiksolarstrom.de
Halbleiter wie Silizium zeichnen sich demnach unter anderem dadurch aus, dass zwischen Valenz- und Leitungsband ein entsprechender Bandabstand besteht.
Bei Temperaturen nahe dem absoluten Nullpunkt sind sie zudem elektrisch nicht leitfähig, das heißt: Das Valenzband ist vollständig mit Elektronen besetzt, das Leitungsband ist hingegen zur Gänze leer.
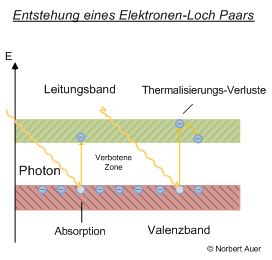
Um Strom leiten und schließlich Solarstrom produzieren zu können, müssen einige Elektronen des Halbleiters in das Leitungsband angehoben werden.
Da das Elektron im Valenzband ein Loch (Defektelektron) zurücklässt, spricht man von der Bildung eines Elektronen-Loch Paares.
Die Energie von Lichtquanten wird genutzt, um die Elektronen im Halbleiter ins Leitungsband anzuheben, ein Vorgang, der in der Photovoltaik-Physik als innerer Photoeffekt bezeichnet wird (vgl. Grafik).
Damit durch den inneren Photoeffekt Solarstrom erzeugt werden kann, muss der Halbleiter zuvor entsprechend dotiert, sprich mit Fremdatomen angereichert und in seiner Leitfähigkeit verändert werden.
Denn erst durch die Dotierung eines Halbleiters bildet sich eine Raumladungszone aus, in der die Elektronen-Loch-Paare getrennt werden.
Das dort herrschende elektrische Feld schickt die Elektronen dann in die n-, die Löcher in die p-dotierte Schicht, wo sie an den Kontakten abgegriffen werden können.

Bandlücke und elektrische Leitfähigkeit
Die Größe der Bandlücke, also der Bandabstand zwischen Valenzband und Leitungsband bestimmt die Leitfähigkeit verschiedener Materialien.
Wie viel Energie (gemessen in Elektronen-Volt eV) ist notwendig, um die Bandlücke zu überwinden?
| Bandlücke Δ WG in Elektronenvolt [eV] | ||
|---|---|---|
| Leiter | Halbleiter | Isolatoren |
| ≤ 0 | > 0 - 3 (5)* | ≥ 3 (5)* |
* Diese Bandlückenwerte variieren in der Fachliteratur
Mit einem Bandabstand von 1,11 eV gehört das in kristallinen Solarzellen verwendete Silizium (Si) ebenso zu den Halbleitern wie bspw. das in der Dünnschichttechnologie eingesetzte Cadmiumtellurid (CdTe) mit einer Bandlücke von 1,44 eV.
Zum Vergleich:
In die Gruppe der Isolatoren fallen die Dimanten, die etwa einen Bandabstand von 7,3 eV aufweisen. In die Gruppe der Leiter fällt der Großteil aller Metalle.
Valenzband und Leitungsband in der Photovoltaik

Zum Vergrößern bitte Grafik anklicken
Photonen heben Elektronen ins Leitungsband -
schematische Darstellung nach Quaschnig (2011)
© 2012 Photovoltaiksolarstrom.de
Halbleiter wie Silizium zeichnen sich demnach unter anderem dadurch aus, dass zwischen Valenz- und Leitungsband ein entsprechender Bandabstand besteht.
Bei Temperaturen nahe dem absoluten Nullpunkt sind sie zudem elektrisch nicht leitfähig, das heißt: Das Valenzband ist vollständig mit Elektronen besetzt, das Leitungsband ist hingegen zur Gänze leer.
Um Strom leiten und schließlich Solarstrom produzieren zu können, müssen einige Elektronen des Halbleiters in das Leitungsband angehoben werden.
Da das Elektron im Valenzband ein Loch (Defektelektron) zurücklässt, spricht man von der Bildung eines Elektronen-Loch Paares.
Die Energie von Lichtquanten wird genutzt, um die Elektronen im Halbleiter ins Leitungsband anzuheben, ein Vorgang, der in der Photovoltaik-Physik als innerer Photoeffekt bezeichnet wird (vgl. Grafik).
Damit durch den inneren Photoeffekt Solarstrom erzeugt werden kann, muss der Halbleiter zuvor entsprechend dotiert, sprich mit Fremdatomen angereichert und in seiner Leitfähigkeit verändert werden.
Denn erst durch die Dotierung eines Halbleiters bildet sich eine Raumladungszone aus, in der die Elektronen-Loch-Paare getrennt werden.
Das dort herrschende elektrische Feld schickt die Elektronen dann in die n-, die Löcher in die p-dotierte Schicht, wo sie an den Kontakten abgegriffen werden können.

Bandlücke und elektrische Leitfähigkeit
Die Größe der Bandlücke, also der Bandabstand zwischen Valenzband und Leitungsband bestimmt die Leitfähigkeit verschiedener Materialien.
Wie viel Energie (gemessen in Elektronen-Volt eV) ist notwendig, um die Bandlücke zu überwinden?
| Bandlücke Δ WG in Elektronenvolt [eV] | ||
|---|---|---|
| Leiter | Halbleiter | Isolatoren |
| ≤ 0 | > 0 - 3 (5)* | ≥ 3 (5)* |
* Diese Bandlückenwerte variieren in der Fachliteratur
Mit einem Bandabstand von 1,11 eV gehört das in kristallinen Solarzellen verwendete Silizium (Si) ebenso zu den Halbleitern wie bspw. das in der Dünnschichttechnologie eingesetzte Cadmiumtellurid (CdTe) mit einer Bandlücke von 1,44 eV.
Zum Vergleich:
In die Gruppe der Isolatoren fallen die Dimanten, die etwa einen Bandabstand von 7,3 eV aufweisen. In die Gruppe der Leiter fällt der Großteil aller Metalle.
Valenzband und Leitungsband in der Photovoltaik

Zum Vergrößern bitte Grafik anklicken
Photonen heben Elektronen ins Leitungsband -
schematische Darstellung nach Quaschnig (2011)
© 2012 Photovoltaiksolarstrom.de
Halbleiter wie Silizium zeichnen sich demnach unter anderem dadurch aus, dass zwischen Valenz- und Leitungsband ein entsprechender Bandabstand besteht.
Bei Temperaturen nahe dem absoluten Nullpunkt sind sie zudem elektrisch nicht leitfähig, das heißt: Das Valenzband ist vollständig mit Elektronen besetzt, das Leitungsband ist hingegen zur Gänze leer.
Um Strom leiten und schließlich Solarstrom produzieren zu können, müssen einige Elektronen des Halbleiters in das Leitungsband angehoben werden.
Da das Elektron im Valenzband ein Loch (Defektelektron) zurücklässt, spricht man von der Bildung eines Elektronen-Loch Paares.
Die Energie von Lichtquanten wird genutzt, um die Elektronen im Halbleiter ins Leitungsband anzuheben, ein Vorgang, der in der Photovoltaik-Physik als innerer Photoeffekt bezeichnet wird (vgl. Grafik).
Damit durch den inneren Photoeffekt Solarstrom erzeugt werden kann, muss der Halbleiter zuvor entsprechend dotiert, sprich mit Fremdatomen angereichert und in seiner Leitfähigkeit verändert werden.
Denn erst durch die Dotierung eines Halbleiters bildet sich eine Raumladungszone aus, in der die Elektronen-Loch-Paare getrennt werden.
Das dort herrschende elektrische Feld schickt die Elektronen dann in die n-, die Löcher in die p-dotierte Schicht, wo sie an den Kontakten abgegriffen werden können.
